La materia è fatta di atomi
Se qualche cataclisma stesse per distruggere tutta la conoscenza scientifica e solo una frase potesse essere lasciata alle future generazioni, quale frase conterrebbe maggiori informazioni con il minor numero di parole?
Io credo che questa frase debba riguardare l’ipotesi atomica: tutte le cose sono fatte di atomi, piccole particelle che si muovono senza sosta, che si attraggono tra loro quando sono vicine e che si respingono se si prova a schiacciarle le une contro le altre.
Vedrete che questa frase, letta con un pò di immaginazione e di riflessione, contiene un’enorme quantità di informazioni sul mondo .
Per illustrare la potenza dell’ipotesi atomica, iniziamo da una goccia d’acqua del diametro di mezzo centimetro.
Se la osserviamo da vicino non vediamo altro che acqua, calma e uniforme.
Anche se la osserviamo con il più potente microscopio ottico, a duemila ingrandimenti, vediamo solo acqua. Ingrandita in questo modo la nostra goccia avrà le dimensioni di una grande stanza (dieci metri di diametro). Con un po’ di fortuna potremmo incontrare uno strano essere a forma di pallone da rugby che nuota avanti e indietro.
Molto interessante. E’ un paramecio. A questo punto ci si potrebbe fermare incuriositi dalle sue ciglia in continuo movimento e dalle contorsioni del suo organismo. Oppure lo si potrebbe ingrandire ancora un po’ per osservare le sue strutture interne, ma questa è biologia.
Noi invece ingrandiamo ancora duemila volte per osservare l’acqua. Ora la nostra goccia ha un diametro di venti chilometri. Adesso cominciamo ad intravvedere una specie di sciame, come se si osservasse da grande distanza la folla di uno stadio.
Per capire di che cosa si tratta, ingrandiamo ancora duemilacinquecento volte. Si vedrebbe qualcosa che assomiglia alla rappresentazione della figura 1. E’ un disegno dell’acqua ingrandita un miliardo di volte. Si tratta, ovviamente, di una rappresentazione schematica e i motivi sono vari. Innanzitutto le particelle sono disegnate con bordi nitidi e ciò non è corretto. In secondo luogo esse sono rappresentate a due dimensioni mentre dobbiamo immaginarle in uno spazio a tre dimensioni.
Notiamo che ci sono due tipi di “palline”: quelle più piccole e nere rappresentano gli atomi di idrogeno mentre le più grandi sono atomi di ossigeno. Gli atomi sono attaccati tra loro in gruppi di tre: due di idrogeno con uno di ossigeno. Ogni gruppetto di atomi legati assieme si chiama molecola.
Dobbiamo anche immaginare il movimento che questo disegno non può mostrarci: tutte le particelle sono in continua agitazione, ruotano, si muovono e sbattono le une contro le altre senza sosta.
Un altro aspetto che un disegno non può mostrare è l’attrazione reciproca delle particelle: ognuna di esse è attirata da tutte le altre. L’intero gruppo è, per modo di dire, “incollato insieme”.
D’altra parte, se proviamo a comprimere il gruppo di particelle, non ci riusciamo: le molecole mantengono tra loro una distanza minima e si respingono con forza se si tenta di schiacciarle tra loro.
Il raggio degli atomi è compreso tra 1 e 2 ångström (1 ångström Å = 0,1 nanometri = un decimiliardesimo di metro = 10-10m). Un modo alternativo per visualizzare queste misure è il seguente: immaginiamo di ingrandire una mela fino alle dimensioni della Terra; un suo atomo sarà grande come la mela originaria.
Immaginiamo ora la gigantesca goccia d’acqua con tutte quelle particelle che si agitano, attaccate assieme, che viaggiano le une in compagnia delle altre. L’acqua conserva il suo volume: a causa dell’attrazione tra le molecole essa non si frammenta. Se la goccia si trova lungo una discesa ed è libera di muoversi, essa fluisce senza scomparire, le sue particelle non se ne vanno via ognuna per conto proprio, proprio a causa dell’attrazione molecolare [o coesione molecolare].
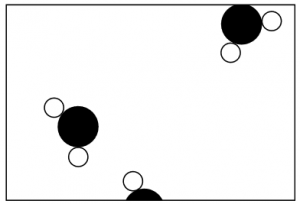
Figura 2 – Il vapore
L’agitazione delle molecole è ciò che noi chiamiamo temperatura. Se aumentiamo la temperatura, aumenta anche l’agitazione. Se riscaldiamo l’acqua l’agitazione aumenta e aumenta anche il volume tra gli atomi. Aumentano ancora la temperatura si arriverà ad un certo punto che l’attrazione tra le molecole non sarà abbastanza forte da tenerle assieme ed esse volano via, si separano le une dalle altre. Ovviamente, è questo il modo per produrre il vapore dall’acqua: aumentando la temperatura; le molecole volano via a causa del loro aumento di velocità. La figura 2 rappresenta il vapore. Questo disegno del vapore ha almeno un difetto: alla normale pressione atmosferica non ci starebbero certo tre molecole d’acqua in un riquadro di queste dimensioni. Gran parte dei riquadri non conterrebbero proprio nulla e solo accidentalmente potremmo incontrare due o tre molecole, come in questa figura.
Nel caso del vapore, rispetto allo stato liquido, sarebbe più facile studiare le caratteristiche delle singole molecole d’acqua. Per semplicità le molecole sono state disegnate con gli atomi di idrogeno che formano tra loro angoli di 120°. In realtà l’angolo è di 105°3′ e la distanza tra il centro dell’atomo di ossigeno e il centro di ciascun atomo di idrogeno è 0,957 Å, quindi sappiamo molto bene com’è fatta una molecola d’acqua.
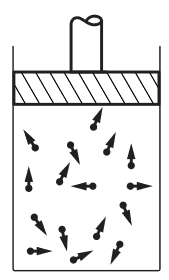
Figura 3
Ora vediamo alcune delle proprietà del vapore e di ogni altro gas. Le molecole, essendo separate le une dalle altre, rimbalzeranno contro le pareti. Immaginate una stanza con un centinaio di palline da tennis che rimbalzano continuamente in tutte le direzioni. Quando esse colpiscono una parete, la parete viene spinta e, se fosse libera di muoversi si allontanerebbe. Ciò significa che il gas esercita una forza dovuta alla loro agitazione. I nostri sensi, non adatti a percepire queste microscopiche spinte (per poterle percepire dovremmo ingrandire il nostro corpo milioni di volte), sentono soltanto una spinta media. Per rinchiudere un gas dobbiamo applicare una pressione. La figura 3 mostra un tipico recipiente per contenere un gas (usato in tutti i libri di testo). Si tratta di un cilindro con un pistone infilato. Al momento non ci interessa quale sia la forma di ciascuna molecola d’acqua e quindi, per semplicità, le rappresentiamo come delle palline da tennis o dei piccoli punti. Esse sono in continuo movimento in tutte le direzioni. Molte di esse colpiscono continuamente il pistone e così, per evitare che il pistone venga spinto via dal recipiente è necessario tenerlo giù con una certa forza. Questa forza necessaria a mantenere fermo il pistone si chiama pressione (per essere precisi, la forza è uguale alla pressione moltiplicata per l’area).
E’ chiaro che la forza è proporzionale all’area perché, se aumentiamo l’area mantenendo lo stesso numero di molecole per ogni centimetro cubo, aumentiamo anche il numero di collisioni con il pistone, con la stessa proporzione in cui aumentiamo l’area.
Ora immaginiamo di mettere il doppio di molecole nel contenitore, in modo da raddoppiare la densità del vapore e manteniamo uguale la loro velocità (ciò la loro temperatura). Ad una prima approssimazione succederà che il numero di collisioni raddoppia e, dato ciascuna collisione ha la stessa energia di prima, la pressione sarà proporzionale alla densità. Naturalmente, se consideriamo la vera natura delle forze che ci sono tra gli atomi, dovremmo aspettarci una leggera diminuzione della pressione a causa della reciproca attrazione. In ogni caso, con una buona approssimazione, finché la densità è abbastanza bassa in modo che non ci siano troppi atomi, la pressione è proporzionale alla densità.
Possiamo osservare anche qualcos’altro: se aumentiamo la temperatura senza cambiare la densità del gas, cioè se aumentiamo la velocità degli atomi, che cosa accade alla pressione? Accade che gli atomi colpiranno con più forza perché sono più veloci e, inoltre, colpiranno con maggior frequenza, perciò la pressione aumenterà. Vedete com’è semplice l’idea della teoria atomica?
Consideriamo un’altra situazione. Supponiamo che il pistone si muova in giù, in modo tale che gli atomi siano leggermente compressi in uno spazio minore. Che cosa accade quando un atomo colpisce il pistone in movimento? Evidentemente acquista velocità dalla collisione. Puoi provare questo fenomeno colpendo una pallina da ping-pong con una racchetta che avanza verso la pallina: essa rimbalza indietro a velocità maggiore rispetto alla sua velocità di arrivo. (Un esempio particolare: se un atomo è immobile e il pistone che avanza lo colpisce, questo prende certamente velocità). In conclusione, gli atomi quando tornano indietro dopo aver colpito il pistone che avanza, saranno più “caldi” rispetto a prima della collisione.. D’altra parte tutti gli atomi del recipiente prima o poi colpiranno il pistone che avanza. Ciò significa che quando si comprime lentamente un gas, la temperatura del gas aumenta. Quindi, una lenta compressione fa aumentare la temperatura di un gas e una lenta espansione fa diminuire la sua temperatura.
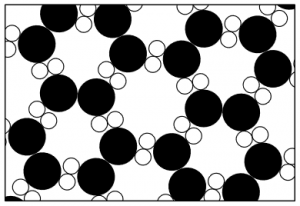
Figura 4 – Il ghiaccio
Ritorniamo alla nostra goccia d’acqua e guardiamo le cose in un’altra direzione. Supponiamo di diminuire la temperatura della goccia. Supponiamo che l’agitazione delle molecole decresca regolarmente. Sappiamo che ci sono forze attrattive tra gli atomi e perciò, dopo qualche tempo, essi dovrebbero smettere di agitarsi così tanto. Ciò che accade alle bassissime temperature è illustrato nella figura 4: le molecole si bloccano in una nuova struttura che è il ghiaccio. Questa rappresentazione schematica del ghiaccio è sbagliata perché è in due dimensioni, ma è giusta dal punto di vista qualitativo. Il punto interessante è che il ghiaccio ha un posto giusto per ciascun atomo, e potete facilmente apprezzare che, data una certa posizione delle molecole d’acqua ad una estremità della goccia congelata, viene determinata con precisione la posizione di qualsiasi altra molecola, anche di quelle che si trovano al lato opposto, a distanza di parecchi “chilometri” (alla scala del nostro ingrandimento). Ciò è dovuto alla struttura rigida delle interconnessioni. Così, se afferriamo una estremità di una stalattite di ghiaccio, l’altra estremità resiste ai nostri tentativi di muoverla. Allo stato liquido invece ogni molecola, a causa della maggiore agitazione, si muove per conto proprio e la posizione di una molecola non implica una posizione definita delle altre. La differenza tra lo stato solido e lo stato liquido è che nel primo caso gli atomi sono sistemati a schiera, formano quella che è chiamata struttura cristallina e che, anche a grande distanza tra loro, non hanno una posizione casuale. La posizione degli atomi su un lato del cristallo è determinato da altri milioni e milioni di atomi che si trovano sull’altro lato. Sebbene la figura 4 rappresenti molte delle caratteristiche della struttura del ghiaccio, essa non ci mostra la disposizione corretta. Una delle caratteristiche corrette è quella che mette in evidenza la simmetria esagonale del ghiaccio. Se si ruota di 60° l’immagine attorno ad un asse, l’immagine ritorna uguale a prima. Questa simmetria del ghiaccio rende conto della forma a sei lati dei fiocchi di neve. Un’altra caratteristica che si può dedurre osservando dalla figura 4 è che il ghiaccio, quando fonde, si restringe. La struttura del ghiaccio mostrata qui contiene molti “buchi”, esattamente come accade in realtà. Quando la struttura si rompe questi buchi possono essere occupati anch’essi da molecole. Gran parte delle sostanze semplici, ad eccezione dell’acqua, aumentano di volume quando fondono. Infatti gli atomi del cristallo solido sono strettamente impacchettati tra loro e, verso la fusione, necessitano di più spazio per potersi agitare di più. Nel caso dell’acqua invece, durante la fusione la struttura aperta del ghiaccio collassa.
Sebbene il ghiaccio sia una forma cristallina “rigida”, la sua temperatura può cambiare: il ghiaccio possiede un calore. Se lo desideriamo, possiamo aumentare la quantità di calore del ghiaccio. Che cos’è il calore nel caso del ghiaccio? Gli atomi non se ne stanno tranquilli. Si agitano e vibrano. Così, sebbene il cristallo abbia un ordine definito, una struttura definita, tutti i suoi atomi vibrano “sul posto”. Aumentando la temperatura essi vibrano con sempre maggiore ampiezza fino a liberarsi dalla loro costrizione. E’ ciò che chiamiamo fusione. Diminuendo la temperatura la vibrazione diminuisce e diminuisce finché, allo zero assoluto, l’atomo può raggiungere una vibrazione minima, ma non zero. Questo movimento minimo non è in grado di fondere le sostanze, con una eccezione: l’Elio. Nell’Elio gli atomi diminuiscono l’agitazione finché possono e, perfino allo zero assoluto, non congelano, a meno che non si aumenti la pressione a tal punto da comprimere tra loro gli atomi e provocare la solidificazione della sostanza.
Copyright © 2024 | MH Purity lite WordPress Theme by MH Themes
